Pembahasan Kimia No. 31 - 35 TKD Saintek SBMPTN 2017 Kode Naskah 157
Jumat, 25 Mei 2018
Tambah Komentar
Pembahasan soal Kimia Tes Kemampuan Dasar Sains dan Teknologi (TKD
Saintek) Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN) tahun
2017 Kode Naskah 157 nomor 31 sampai dengan nomor 35 tentang:
- konfigurasi elektron,
- hibridisasi elektron,
- stoikiometri,
- pereaksi pembatas, dan
- gas ideal.
Soal No. 31 tentang Konfigurasi Elektron
Nomor atom R adalah 33. Konfigurasi elektron ion R3− adalah ….
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 5s2 4d6
B. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 5s1
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d8 4p6 5s2
D. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
E. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
B. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 5s1
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d8 4p6 5s2
D. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
E. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Pembahasan
Konfigurasi atom R adalah:
33R = [Ar] 4s2 3d10 4p3
Ion R3− adalah atom R yang menangkap 3 elektron. 3 elektron ini akan bergabung dengan elektron terluar. Sehingga konfigurasinya adalah:
33R3− = [Ar] 4s2 3d10 4p3+3
= [Ar] 4s2 3d10 4p6
= [Ar] 4s2 3d10 4p6
Jadi, konfigurasi elektron ion R3− adalah opsi (D).
Soal No. 32 tentang Hibridisasi Elektron
Orbital hibrida yang digunakan oleh atom B (nomor atom = 5) untuk berikatan pada molekul BF3 adalah ….A. sp
B. sp2
C. sp3
D. dsp2
E. sp2d
B. sp2
C. sp3
D. dsp2
E. sp2d
Pembahasan
Perhatikan konfigurasi atom pusat, yaitu konfigurasi atom B berikut ini!
5B = 1s2 2s2 2p1
Elektron valensi atom B adalah 2s2 2p1 (ns np). Distribusi elektronnya adalah sebagai berikut:

Dengan distribusi elektron seperti di atas, hanya 1 elektron saja yang dapat berpasangan dengan elektron dari atom F. Agar dapat menangkap 3 elektro dari atom F maka orbital s harus melakukan promosi elektron sebagai berikut:

Dengan demikian, 3 elektron dari atom F dapat masuk ke orbital s dan 2 orbital p sehingga hibridisasinya adalah sp2.
Jadi, orbital hibrida untuk molekul BF3 adalah sp2 (B).
Soal No. 33 tentang Stoikiometri
Perhatikan persamaan reaksi (belum setara) berikut:M3O4(s) + CO(g) → MO(s) + CO2(g)
Jika 2,8 g CO (Ar O = 16; C = 12) bereaksi sempurna menghasilkan 21,6 g MO, Ar M adalah ….
A. 14
B. 27
C. 56
D. 72
E. 103
Jika 2,8 g CO (Ar O = 16; C = 12) bereaksi sempurna menghasilkan 21,6 g MO, Ar M adalah ….
A. 14
B. 27
C. 56
D. 72
E. 103
Pembahasan
Persamaan reaksi setara untuk reaksi di atas adalah:
M3O4(s) + CO(g) → 3MO(s) + CO2(g)
Jumlah mol CO adalah:

Karena koefisien MO 3 kali koefisien CO maka mol MO juga 3 kali mol CO.
mol MO = 3 × mol CO
= 3 × 0,1 mol
= 0,3 mol
= 3 × 0,1 mol
= 0,3 mol
Nilai mol MO ini bisa kita gunakan untuk mencari Mr MO.

Selanjutnya, dari nilai Mr MO di atas, kita dapat menentukan Ar M.
Mr MO = 72
Ar M + Ar O = 72
Ar M + 16 = 72
Ar M = 56
Ar M + Ar O = 72
Ar M + 16 = 72
Ar M = 56
Jadi, Ar atom M adalah 56 (C).
Soal No. 34 tentang Pereaksi Pembatas
Sebanyak 1 mmol Mg(OH)2 direaksikan dengan 5 mL HCl 0,5 M menurut reaksi (belum setara) berikut:Mg(OH)2(s) + HCl(aq) → MgCl2(aq) + H2O(l)
Konsentrasi HCl setelah reaksi adalah ….
A. 0,050 M
B. 0,075 M
C. 0,100 M
D. 0,125 M
E. 0,500 M
Konsentrasi HCl setelah reaksi adalah ….
A. 0,050 M
B. 0,075 M
C. 0,100 M
D. 0,125 M
E. 0,500 M
Pembahasan
Diketahui:
mol Mg(OH)2 = 1 mmol
mol HCl = 5 × 0,5 mmol
= 2,5 mmol
= 2,5 mmol
Nilai mol dari kedua pereaksi sudah diketahui dan tidak
disebutkan bahwa reaksi di atas tepat bereaksi. Berarti ada pereaksi
pembatas (pereaksi yang habis bereaksi) dan pereaksi berlebih.
Oleh karena itu, perlu kita buat tabel berikut (dengan menyetarakan reaksi terlebih dahulu).

Berdasarkan tabel di atas, tampak bahwa HCl merupakan pereaksi berlebih yang mempunyai sisa reaksi 0,5 mmol.
Nilai molaritas sisa HCl tersebut adalah:

Keterangan:
Volume total yang digunakan hanya volume HCl saja karena Mg(OH)2 tidak berfase larutan tapi padatan.
Jadi, konsentrasi HCl setelah reaksi adalah 0,100 M (C).
Soal No. 35 tentang Gas Ideal
Sebuah tabung bervolume tetap berisi 6 g gas H2 (Ar H = 1) memiliki tekanan 12 atm pada temperatur tertentu. Ke dalam tabung tersebut ditambahkan gas Ne (Ar Ne = 20) sehingga tekanannya menjadi 40 atm tanpa mengubah temperatur. Massa gas total di dalam tabung tersebut adalah ….A. 26 g
B. 56 g
C. 140 g
D. 146 g
E. 286 g
B. 56 g
C. 140 g
D. 146 g
E. 286 g
Pembahasan
Gas ideal dirumuskan sebagai:
PV = nRT
Karena volume tabung tetap dan bekerja suhu tertentu (V dan T konstan) maka berlaku hubungan:
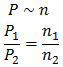
Indeks (1) mewakili gas H2 sedangkan indeks (2) mewakili gas Ne.
P1 = 12 atm
P2 = (40 − 12) atm
= 28 atm
= 28 atm
n1 = (gr H2)/(Mr H2 )
= 6/2 mol
= 3 mol
= 6/2 mol
= 3 mol
n2 = (gr Ne)/(Mr Ne)
= (gr Ne)/20
= (gr Ne)/20
Nah, sekarang kita masukkan data-data di atas.

Dengan demikian massa gas total adalah:
gr total = gr H2 + gr Ne
= (6 + 140) g
= 146 g
= (6 + 140) g
= 146 g
Jadi, massa gas total dalam tabung tersebut adalah 246 g (D).


Belum ada Komentar untuk "Pembahasan Kimia No. 31 - 35 TKD Saintek SBMPTN 2017 Kode Naskah 157"
Posting Komentar